Natriumhydrid
Spørgsmålet om Natriumhydrid er afgørende i dagens samfund. I årevis har Natriumhydrid været genstand for debat og forskning, og dets indflydelse strækker sig til forskellige områder, fra politik til videnskab. I denne artikel vil vi udforske de forskellige aspekter af Natriumhydrid og dens indflydelse på folks daglige liv. Vi vil analysere dens historiske relevans, dens udvikling over tid og mulige fremtidige implikationer. Derudover vil vi undersøge forskellige perspektiver på Natriumhydrid, hvilket giver et bredere og dybere syn på emnet. Gennem denne omfattende analyse håber vi at kunne kaste lys over Natriumhydrid og tilbyde en mere fuldstændig forståelse af dets betydning i dagens samfund.
| Natriumhydrid | |
|---|---|
 | |
 | |
| IUPAC-navn Natriumhydrid | |
| Generelt | |
| Molekylformel | NaH |
| Molarmasse | 23,99771 g/mol |
| Fremtræden | Hvidt eller gråt fast stof |
| CAS-nummer | |
| EC-nummer | 231-587-3 |
| PubChem | |
| SMILES | . |
| InChI | 1/Na.H/q+1;-1 |
| Kemiske egenskaber | |
| Massefylde | 1,396 g/cm3 |
| Opløselighed i vand | Reagerer med vand |
| Opløselighed | Uopløselig i ammoniak, benzen, tetraklorkulstof og kuldisulfid |
| Smeltepunkt | Dekomponerer ved 300 °C (573 K) |
| Refraktionsindeks | 1,470 |
| Struktur | |
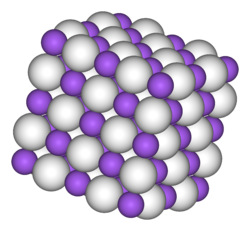
| Krystalstruktur | Fladecentreret kubisk kuglepakning (NaCl-struktur)[1] |
| Koordinationstal | Oktaedrisk (Na+) Oktaedrisk (H−) |
| Termokemi | |
| DeltaHf | −56,4 kJ·mol−1[2] |
| Std. molar entropi S | 40 J·mol−1·K−1[2] |
| Std. molar varmekapacitet, cp | 36,4 J·mol-1·K-1 |
| Sikkerhed | |
| NFPA 704 | |
| Flammepunkt | Brændbar |
| Beslægtede stoffer | |
| Andre anioner | Natriumborhydrid |
| Andre kationer | Lithiumhydrid Kaliumhydrid |
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |
Natriumhydrid er en kemisk forbindelse med sumformlen NaH. Det anvendes primært som en meget stærk base i organisk syntese. Natriumhydrid er et saltlignende hydrid bestående af kationen Na+ og anionen H−. Det er uopløseligt i organiske opløsningsmidler (det kan dog opløses i smeltet natrium), hvilket er i overensstemmelse med, at hydridanionen H- aldrig er blevet påvist i opløsning. På grund af natriumhydrids uopløselighed foregår alle kemiske reaktioner med natriumhydrid på overfladen af det faste stof.
Egenskaber og struktur
Natriumhydrid fremstilles ved direkte reaktion mellem brint og flydende natrium.[3] Rent natriumhydrid er farveløst, men antager efterhånden et gråt skær. Natriumhydrid er ca. 40 % tættere end natrium (hvis massefylde er 0,968 g/cm3).
Natriumhydrid antager en NaCl-krystalstruktur ligesom hydriderne af de øvrige alkalimetaller (LiH, KH, RbH og CsH). I denne krystalstruktur er hver Na+-ion omgivet af seks H−-ioner i et oktaedrisk mønster. Ionradierne af H− (146 pikometer i NaH) og F− (133 pm) er forholdsvis ens bedømt ud fra Na-H- og N-F-afstandene.[4]
Sikkerhed
Natriumhydrid kan selvantænde i atmosfærisk luft. Hvis forbindelsen kommer i kontakt med vand, frigives der brint, som er brændbar. Ved hydrolyse omdannes natriumhydrid til natriumhydroxid (NaOH), som er en stærk vandopløselig base. I praksis opslæmmes natriumhydrid typisk i olie, så det er sikrere at håndtere i luft.[5]
Referencer
- ^ Housecroft, Catherine E., og Constable, Edwin C. Chemistry, 4th Edition, p. 295. Pearson Education (2010), ISBN 978-0-273-71545-0. (engelsk)
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. s. A23. ISBN 0-618-94690-X. (engelsk)
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5. (engelsk)
- ^ Wells, A.F. (1984). Structural Inorganic Chemistry, Oxford: Clarendon Press (engelsk)
- ^ MSDS 60% NaH in mineral oil (engelsk)